Кількість речовини: формули, приклади та пояснення
У шкільній лабораторії завжди панує особлива атмосфера. Пробірки, колби, реактиви — і магія перетворень, що відбувається на наших очах. Але за цією магією стоїть чітка наука, де кількість речовини стає нашим головним інструментом для розуміння хімічних процесів. Це поняття допомагає нам перетворити абстрактні формули на конкретні числа і зрозуміти, скільки саме речовини бере участь у реакції.
Що таке кількість речовини?
Кількість речовини — це фізична величина, яка показує число структурних частинок (атомів, молекул, йонів) у певній порції речовини. Позначаємо її літерою n або ν, а вимірюємо в молях.
Один моль — це кількість речовини, що містить стільки частинок, скільки атомів міститься в 12 грамах вуглецю-12. Звучить складно? Насправді це просто певне число частинок, як десяток чи сотня, тільки набагато більше.
Стала Авогадро — магічне число
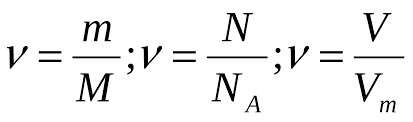 Італійський вчений Амедео Авогадро ще в XIX столітті припустив, що в однакових об’ємах різних газів за однакових умов міститься однакова кількість молекул. Пізніше вчені визначили, що в одному молі будь-якої речовини міститься 6,022 × 10²³ частинок. Це число назвали сталою Авогадро (NA).
Італійський вчений Амедео Авогадро ще в XIX столітті припустив, що в однакових об’ємах різних газів за однакових умов міститься однакова кількість молекул. Пізніше вчені визначили, що в одному молі будь-якої речовини міститься 6,022 × 10²³ частинок. Це число назвали сталою Авогадро (NA).
Щоб уявити це число, подумайте: якщо розсипати моль піщинок по всій поверхні Землі, утвориться шар товщиною близько 3 метрів!
Як обчислити кількість речовини?
Є три головні способи визначити кількість речовини:
- За масою: n = m / M Де m — маса речовини (г), M — молярна маса (г/моль)
- За об’ємом газу: n = V / Vm Де V — об’єм газу (л), Vm — молярний об’єм (22,4 л/моль за нормальних умов)
- За числом частинок: n = N / NA Де N — число частинок, NA — стала Авогадро
Приклади розв’язання задач
Приклад 1. Обчислимо кількість речовини води масою 36 г. Молярна маса води: M(H₂O) = 18 г/моль n = m / M = 36 г / 18 г/моль = 2 моль
Приклад 2. Визначимо кількість молекул у 5,6 л кисню за нормальних умов. n = V / Vm = 5,6 л / 22,4 л/моль = 0,25 моль N = n × NA = 0,25 моль × 6,022 × 10²³ молекул/моль = 1,5 × 10²³ молекул
 Застосування в хімічних реакціях
Застосування в хімічних реакціях
Коли ми печемо торт, важливо дотримуватися пропорцій інгредієнтів. Так само і в хімічних реакціях: співвідношення кількостей речовин має відповідати коефіцієнтам у рівнянні реакції.
Розглянемо реакцію горіння метану: CH₄ + 2O₂ → CO₂ + 2H₂O
З рівняння бачимо, що для повного згоряння 1 моль метану потрібно 2 моль кисню, а утворюється 1 моль вуглекислого газу і 2 моль води.
Поширені помилки та поради
Найчастіша помилка — плутанина між масою та кількістю речовини. Ми часто говоримо: “Візьміть 5 грамів солі”. Але для хімічних розрахунків треба знати кількість речовини в молях.
Також не забувайте, що молярний об’єм 22,4 л/моль стосується лише газів за нормальних умов (температура 0°C і тиск 101,3 кПа).
Кількість речовини — це місток між мікросвітом атомів і нашим макросвітом. Завдяки цьому поняттю ми можемо точно визначити, скільки атомів чи молекул беруть участь у реакціях, і передбачити результати експериментів.
Спробуйте самостійно розв’язати кілька задач на обчислення кількості речовини — і ви відчуєте, як абстрактні формули перетворюються на реальні числа, а хімія стає точною наукою.

 Застосування в хімічних реакціях
Застосування в хімічних реакціях